PESQUISA CLÍNICA
Pesquisa clínica, ensaio clínico ou estudo clínico são termos utilizados para designar um processo de investigação científica envolvendo seres humanos, que permite testar um medicamento inovador ou melhorá-lo.
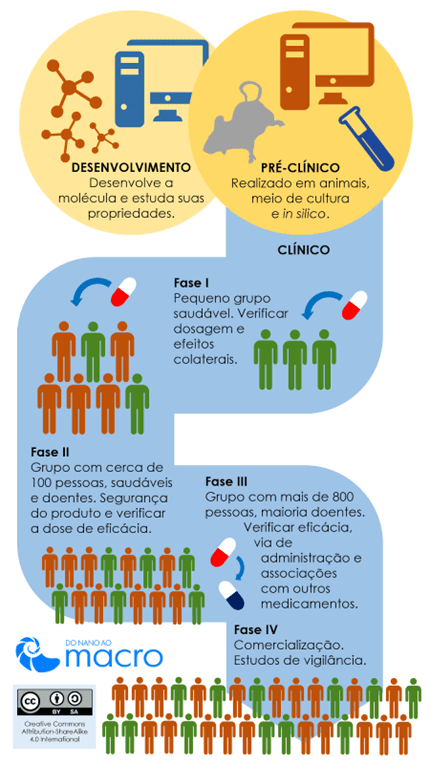
Depois que esse medicamento é desenvolvido e é aprovado nos testes pré-clínicos, é iniciada a pesquisa clínica, que se divide em quatro fases. Em cada uma delas são obtidas determinadas informações, conforme figura a seguir:
Imagem retirada de http://www.nano-macro.com
CENTRO DE PESQUISA CLÍNICA
A condução de um estudo clínico é realizada em um Centro de Pesquisa, que pode ser público ou privado e é selecionado pelo patrocinador do estudo, conforme critérios de seleção.
O Centro de Pesquisa deve possuir uma boa estrutura física e profissional para garantir a segurança e confiabilidade do estudo.
EQUIPE DE PESQUISA CLÍNICA
A equipe do Centro de pesquisa é composta por:
Investigador Principal: médico responsável pelo Centro e pela pesquisa a ser realizada.
Sub-investigador: outros médicos que atuam no Centro de Pesquisa, sob responsabilidade do Investigador principal.
Coordenadora de Pesquisa Clínica: responsável por realizar toda a administração e logística do Centro entre os participantes, médicos e indústria farmacêutica.
Farmacêutico de Pesquisa Clínica: responsável pelo armazenamento e manipulação do produto investigacional.
Enfermeira de Pesquisa Clínica: membro da equipe que aplica os medicamentos nos pacientes, em alguns casos, realiza coleta de sangue, pesa os pacientes, etc.
REGULAMENTAÇÃO DA PESQUISA CLÍNICA
Para um estudo clínico ser realizado no Brasil, ele deve ser submetido e aprovado pelo Comitê Nacional de Ética em Pesquisa (CONEP) e pela Agência Nacional de Vigilância Sanitária (ANVISA). E para o estudo ser conduzido em determinado Centro de Pesquisa, deve ser aprovado pelo Comitê de Ética em Pesquisa (CEP). O objetivo principal das avaliações éticas e regulatórias é garantir a segurança e os direitos do paciente.
PROTEÇÃO DO PARTICIPANTE NA PESQUISA CLÍNICA
Para participar de um estudo clínico, o paciente que tiver interesse, deverá preencher um Termo de Consentimento Livre e Esclarecido, o TCLE, que é um documento de grande importância e garante que os direitos do participante serão respeitados. Esse documento traz informações sobre o estudo, em linguagem simples, clara e compreensível, informando sobre como será o estudo, como será o acompanhamento, os benefícios, os riscos, quais as complicações, riscos e efeitos colaterais do medicamento. Quais são as outras possibilidades de tratamento para aquela doença, quem é o responsável pela condução do estudo e seus contatos, entre outras informações pertinentes ao estudo.
A assinatura do TCLE comprova a participação voluntária do participante na pesquisa e nenhum procedimento pode ser realizado antes de sua assinatura.
PATROCINADOR E CUSTO DA PESQUISA
Quem patrocina a pesquisa clínica?
O patrocinador pode ser uma empresa pública ou privada, como Indústrias farmacêuticas, por exemplo, que arcam financeiramente com o custo do estudo clínico, não tendo o participante nenhum gasto com medicamentos, exames ou consultas médicas destinadas ao estudo.
No Brasil, a participação de um paciente em pesquisa clínica deve ser voluntária, não sendo permitido o pagamento de qualquer natureza ao participante de uma pesquisa, exceto reembolso de transporte e alimentação, quando necessário e de acordo com o estudo. O participante de pesquisa também não pode pagar para participar da pesquisa, sendo incluso no estudo somente se atender a todos os critérios pré-definidos.
PESQUISA CLÍNICA NO CENTRO ONCOLÓGICO
A pesquisa clínica foi implantada no Centro Oncológico em 2009. Somos o único centro de pesquisa clínica em oncologia da região do Alto Tietê.
PORQUE O CENTRO ONCOLÓGICO É ÚNICO
Porque possuímos a infraestrutura necessária para condução de um estudo clínico, profissionais capacitados e parcerias seletas para proporcionar um serviço de excelência para os participantes e patrocinadores, além disso, possuímos grande experiência na condução de estudos clínicos, principalmente os de fases II e III.
O primeiro estudo conduzido Pelo Centro Oncológico teve início em 2010, e desde então vários outros estudos já foram conduzidos com sucesso e atualmente temos 3 estudos ativos, sendo um com recrutamento aberto.
A pesquisa clínica é realizada de acordo com as boas práticas clínicas, seguindo regulamentações nacionais e padrões internacionais, estabelecidas para estudos que envolvam seres humanos.
| INDICAÇÃO | FASE | ANO |
| Ca Esôfago | II | 2010 |
| Ca Mama HER2+ | II | 2010 |
| Ca Próstata | III | 2010 |
| Ca Mama | Observacional | 2011 |
| Ca Mama | III | 2011 |
| Prevenção de Náuseas e Vômito induzidos pela quimioterapia | Única | 2011 |
| Ca Próstata (mCRPC) | III | 2011 |
| Ca Pulmão | III | 2011 |
| Ca Próstata (mCRPC) | III | 2011 |
| Ca Mama | III | 2012 |
| Ca Próstata | II | 2012 |
| Câncer em geral | III | 2012 |
| Ca Cabeça/Pescoço | III | 2014 |
| Risco de Tromboembolismo Venoso em Paciente oncológico | III | 2017 |
| Ca Pulmão | III | 2018 |
| Ca Mama | Observacional | 2019 |
| CEC Pele | III | 2021 |
OBJETIVOS
- Beneficiar os pacientes facilitando o acesso a novos medicamentos. O paciente é monitorado permanentemente durante sua participação no estudo, além da medicação que o paciente recebe, as consultas e exames não têm nenhum custo ao paciente.
- A instituição tem a oportunidade de participar do desenvolvimento científico de um novo produto e os médicos e pacientes têm a oportunidade de conhecer medicamentos inovadores precocemente.
ESTUDOS ATIVOS
Estudo C-post (RECRUTANDO)
https://www.clinicaltrials.gov/ct2/show/study/NCT03969004?term=R2810-ONC-1788&draw=2&rank=1
Braço de Estudo
Estudo Duplo Cego Randomizado – Fase III Cemiplimabe x Placebo
Critérios de Inclusão (principais)
- Paciente com ressecção de CSCC patologicamente confirmado (apenas lesão primária de CSCC, ou CSCC primário com envolvimento nodal, ou metástase nodal de CSCC com lesão primária conhecida de CSCC previamente tratada dentro do escalão linfonodal de drenagem), com ressecção macroscópica de toda a doença
- CSCC de alto risco, conforme definido no protocolo
- Conclusão da radioterapia pós-operatória (RT) com intenção curativa dentro de 2 a 10 semanas após a randomização
- Status de desempenho do Eastern Cooperative Oncology Group (ECOG PS) ≤1
- Função hepática, renal e da medula óssea adequada, conforme definido no protocolo
- Nota: Aplicam-se outros critérios de inclusão/exclusão definidos pelo protocolo
Estudo LB1802 Zedora – trastuzumabe biossimilar Estudo de mundo real
https://www.clinicaltrials.gov/ct2/show/NCT03892655?term=LB1802&draw=2&rank=1
Braço de Estudo
Estudo Observacional Trastuzumabe biossimilar (ZEDORA)
Critérios de Inclusão (principais)
- Pacientes do sexo feminino com 18 anos ou mais
- Diagnóstico de câncer de mama em estágio inicial I a III confirmado por exame histopatológico de acordo com as diretrizes locais.
- Tumor positivo para o receptor do fator de crescimento epidérmico humano 2 (her2) por imuno-histoquímica ou fish (fluorescência in situ hibridização), de acordo com a diretriz de avaliação da asco de 2018 [j clin oncol 36:2105, 2018].
- Uso de pelo menos uma dose de trastuzumabe biossimilar (zedora) como terapia adjuvante, independentemente do uso prévio de trastuzumabe ou zedora neoadjuvante ou do tipo de quimioterapia combinada com o anticorpo.
- Assinatura do termo de consentimento informado (tcle).
Estudo Empower
https://www.clinicaltrials.gov/ct2/show/NCT03088540?term=R2810-ONC-1624&draw=2&rank=1
Braço de Estudo
Estudo Aberto Global Randomizado – fase III Cemiplimabe x Quimioterapia padrão
Critérios de Inclusão (principais)
- Pacientes com NSCLC escamoso ou não escamoso documentado histologicamente ou citologicamente com doença em estágio IIIB ou IIIC que não são candidatos ao tratamento com quimiorradiação concomitante definitiva ou pacientes com doença em estágio IV que não receberam tratamento sistêmico prévio para NSCLC recorrente ou metastático
- Tecido tumoral fixado em formalina de arquivo ou recém-obtido de um local metastático/recorrente, que não tenha sido previamente irradiado
- Células tumorais que expressam PD L1 acima de uma porcentagem específica de células tumorais por IHC realizada pelo laboratório central
- Pelo menos 1 lesão mensurável radiograficamente por RECIST 1.1
- Nota: Aplicam-se outros critérios de inclusão/exclusão definidos pelo protocolo
COMO FAZER PARA PARTICIPAR DE UM ESTUDO CLÍNICO NO CENTRO ONCOLÓGICO?
Caso tenha interesse por algum estudo, entrar em contato com Leila ou Rosana:
Telefone / Whatsapp (11) 4795-4792
E-mail: pesquisaclinica@centrooncologico.com.br
REFERÊNCIAS:
- https://www.sbppc.org.br/pesquisa-clinica – acesso em 27/06/2022
- https://www.fda.gov/patients/clinical-trials-what-patients-need-know/what-are- different-types-clinical-research – acesso em 27/06/2022
- https://www.roche.com.br/pt/por-dentro-da-roche/pesquisa-clinica-permite-desenvolver-e-melhorar-tratamentos.html – acesso em 27/06/2022
- https://www.clinicaltrials.gov/ct2/show/NCT03969004?term=R2810-ONC-1788&draw=2&rank=1 – Acesso em 04/07/2022